◇アルカリ金属って・・・?
「アルカリ金属」と、いきなり言われても良く分かりませんよね。
そんな、アルカリ金属について分かりやすくないかもしれないけれど説明します。
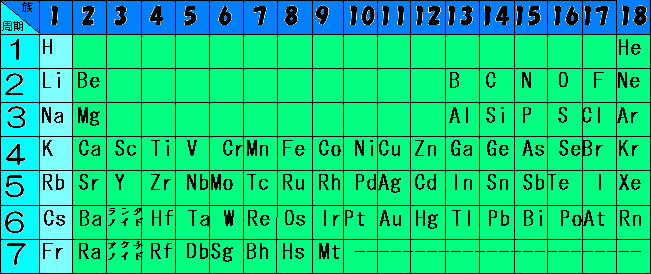
うゎ・・・周期表かよ・・・と思うかもしれませんが、これがあると説明が便利なので用いる事にします。
周期表の、一番右の縦列(1族)である1族の元素の中で、水素以外の元素を「アルカリ金属」といいます。
アルカリ金属は、リチウム、ナトリウム、カリウム、ルビウム、セシウム、フランシウムです。
アルカリ金属には、共通していくつかの特徴があります。
- 水(H2O)と反応して、水酸化物になり、強塩基性。
- 酸化しやすい。
- 火をつけると燃える。
- 炎色反応がある。
∮水酸化とは・・・?
まず、「水酸化」という言葉を説明します。
「水酸化」とは、H2Oの中のOH(水酸化物イオン)を結びつく事をいいます。
こんな事をいっても言葉じゃ余計に分かりにくいので、下に図を示します。
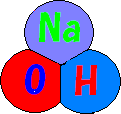
(これは、ナトリウムと水の反応です。)
一番左にあるのが水の分子、その次がナトリウム原子です。そしてイコールの右側に水酸化ナトリウムの分子と水素原子があります。
①水とナトリウムが反応すると、H2O(H-OH)の中のOH-がナトリウムと結合して、水酸化ナトリウムになります。
②すると、H2Oの中のHが余りますね。さて、これはどうなるのでしょう?
実はこの水素・・・気体として出ていくんです!!(大して凄くない・・・
その後の反応は以下のとおりです。
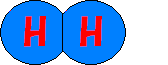
③水素原子が2つ結合して、水素分子になります。
でもチョット待った!!!!もう一つの水素原子はどこから来たのでしょう?
実はこれ、少し考えると分かる事なのです。
この反応は、一ヶ所で起きているわけではないですよね?という事は、同時に何回も反応が起きた場合、水素原子の余りが大量に
出ることになります。すると、水素原子の2つ組がいくつもできます。 と、ここで水素原子がどうして2つになったんだ?という謎は解けるはずです。
理由は、同じ反応によって余った水素原子が2つ寄り集まった事で水素の分子になったからなのです。
この化学反応を、<化学反応式>で書くと、次のようになります。
2H2O + 2Na → 2NaOH + H2
さて、次に「酸化」について説明します。
「酸化」とは、(皆さんもう知っているかもしれませんが)酸素と結びつく事です。
「酸化しやすい」というのと、「火をつけると燃える」というのは、似たような意味になります。
酸化しやすいということは、酸素との結合をしやすいという事です。しかしこれはあまり正確じゃないんです。正確に言うと、「色々な元素と結合しやすい」となります。
塩酸の中にナトリウムを入れれば、塩素と結合して塩化ナトリウムになります。これは、食塩のことですね。
これをいいかえると、反応性が高いといえるのです。
そして、「火をつけると燃える」というのは、「火」というきっかけによって、酸素との反応が激しくなるという意味になり、ただでさえ酸化しやすいものに拍車をかける事で
燃焼という作用が起きるっていうわけです。
さぁ、最後になりましたが、「炎色反応」について説明します。
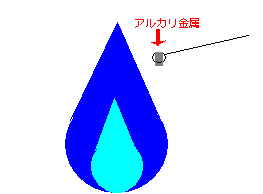
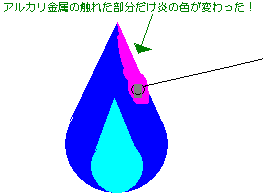
「炎色反応」というのは、ある物質を含んだ物を火にかざす事で、色の付いた炎になる事です。
ここまで長々と文章続きだったので、久しぶりにイラストを持ってきます。
今回は アルカリ金属でしたが、塩素なども炎色反応を示します。
この反応は、花火などが良い例になってくれます。
手持ち花火は、時間がたつと色が変わっていきますよね?あれは、何層にも分けて違う金属を仕込んであるからなんです。時間の経過とともに順番に燃えて、色が変わっていく・・・といった具合です。
代表的な性質を挙げましたが、この説明について分からないことや、「これはどうなるの??」といった疑問は、大歓迎です!
そういった事については、「雑談の間」の北海道エリアに書き込んでいただければ幸いです。
説明下手な私による説明でしたが、訂正などあれば、そちらも雑談の間に書き込んでください。
ではこれで、アルカリ金属についての説明を終わります。
雑談の間へ
気まぐれの間に戻る
トップへ戻る